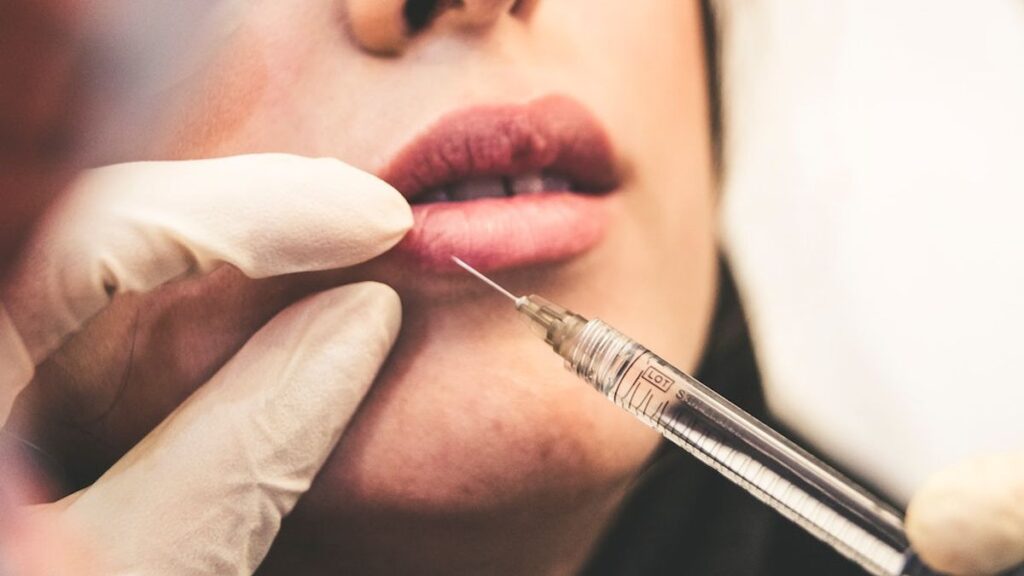
BANDUNG,TM.ID: Otoritas Ilmu Kesehatan Singapura (HSA) tengah menyelidiki kasus suntik filler yang dilakukan seorang wanita menjadi petaka kebutaan.
Insiden tersebut terjadi pada Juli 2023, merupakan laporan efek samping lokal yang berujung buta mendadak akibat filler dermal.
Melansir CNA, filler dermal dikelaskan dalam HSA sebagai perangkat medis kelas D, yang merupakan tingkat resiko sangat tinggi.
BACA JUGA: Bahaya! Hindari Skincare Mengandung Eksfolian usai Terpapar Sinar Matahari
Wanita yang melakukan praktik kecantikan itu diberikan AestheFill, merek filler yang digunakan untuk memperbaiki kerutan kulit dan lipatan wajah untuk sementara waktu dengan menyuntikkan ke lapisan subkutan kulit wajah.
AestheFill pada 1 Oktober 2021 telah resmi terdaftar di Singapura sebagai salah satu produk estetika yang tersedia di pasar.
Namun, baru-baru ini, beredar kabar bahwa HSA sedang melakukan penyelidikan terhadap produk ini terkait dengan potensi cacat yang dapat memengaruhi keamanan dan kualitas produk tersebut.
HSA memiliki tanggung jawab untuk memastikan bahwa produk-produk kesehatan yang beredar di pasaran aman dan memenuhi standar kualitas yang ditetapkan. Dalam konteks ini, HSA sedang aktif menyelidiki apakah ada cacat atau masalah terkait dengan batch tertentu dari AestheFill yang dapat membahayakan kesehatan konsumen, apalagi dampaknya menyebabkan buta.
Menurut pihak berwenang, jika HSA menemukan masalah yang berhubungan dengan produk atau batch tertentu dari AestheFill, tindakan yang diperlukan akan segera diambil. Ini termasuk kemungkinan penarikan produk terdampak dari pasar atau meminta perusahaan produsen untuk mengatasi masalah tersebut dengan segera.
Langkah-langkah ini bertujuan untuk melindungi kesehatan dan keselamatan konsumen yang menggunakan produk tersebut.
Adalah penting untuk mencatat bahwa distributor AestheFill, yaitu Parvus, telah mematuhi persyaratan peraturan HSA. Mereka melaporkan kejadian yang terkait dengan produk ini kepada HSA pada tanggal 29 Juli 2023, sesuai dengan ketentuan yang mengharuskan perusahaan untuk melaporkan kejadian buruk dalam jangka waktu 10 hari yang ditentukan.
Hal ini menunjukkan transparansi dan ketaatan terhadap regulasi yang berlaku dalam industri ini.
HSA juga memberikan klarifikasi terkait laporan kejadian buruk yang telah mereka terima. Menurut HSA, belum ada peningkatan nyata dalam laporan kejadian buruk yang berkaitan dengan implan estetika, termasuk filler dermal seperti AestheFill.
Akan tetapi, perlu diingat bahwa dalam penggunaan filler dermal, terdapat risiko yang diketahui terkait dengan penyumbatan pembuluh darah, yang dalam beberapa kasus dapat mengakibatkan kebutaan. Resiko ini biasanya dicantumkan dalam Petunjuk Penggunaan (IFU) yang diberikan kepada dokter yang menggunakannya.
Dalam IFU untuk AestheFill, disebutkan bahwa injeksi ke dalam pembuluh darah “harus dihindari karena dapat menyebabkan oklusi pembuluh darah.”
Oleh karena itu, sangat penting bagi dokter dan pasien yang menggunakan produk ini untuk mematuhi petunjuk penggunaan dengan cermat dan berhati-hati dalam prosedur yang dilakukan.
Penyelidikan yang sedang dilakukan oleh HSA adalah langkah yang sangat penting dalam memastikan keamanan dan kualitas produk-produk estetika yang tersedia di pasar.
Konsumen dihimbau untuk selalu mengikuti perkembangan penyelidikan ini dan mematuhi panduan yang diberikan oleh otoritas kesehatan terkait penggunaan produk estetika demi menjaga kesehatan dan keselamatan mereka.
(Saepul/Usamah)